创新药临床试验审评审批时限将缩短至30日
AI导读:
国家药监局发布征求意见稿,提出对符合要求的创新药临床试验申请审评审批时限由60个工作日缩短为30个工作日,以支持创新药研发,加速医药产业高质量发展。此举将显著缩短审评审批时间,加快创新药研发进度。
创新药再迎政策东风,符合要求的创新药临床试验申请审评审批时限有望大幅缩短,由原先的60个工作日减至30个工作日。
6月16日,为深入贯彻《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号),国家药监局发布了《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》,公开征求社会各界意见。
征求意见稿明确指出:
为加速以临床价值为导向的创新药研发进程,提升研发效率,对满足条件的创新药临床试验申请,将在30个工作日内完成审评审批。
这一快速通道主要支持国家重点研发品种,鼓励全球早期同步研发及国际多中心临床试验,旨在服务临床急需,推动国家医药产业高质量发展。
纳入30日审评审批通道的申请需为中药、化学药品、生物制品1类创新药,且能按要求提交完整申报资料,并符合以下条件之一:国家支持的重点创新药;入选国家药品监督管理局药品审评中心儿童药星光计划、罕见病关爱计划的品种;全球同步研发品种。
回顾2025年1月发布的《国务院办公厅意见》,其中已提出“优化临床试验审评审批机制”,即在部分地区试点将审评审批时限缩短至30个工作日。此次征求意见稿的发布,标志着这一试点政策将在全国范围内进一步推广,无疑将极大加速创新药的研发进程。
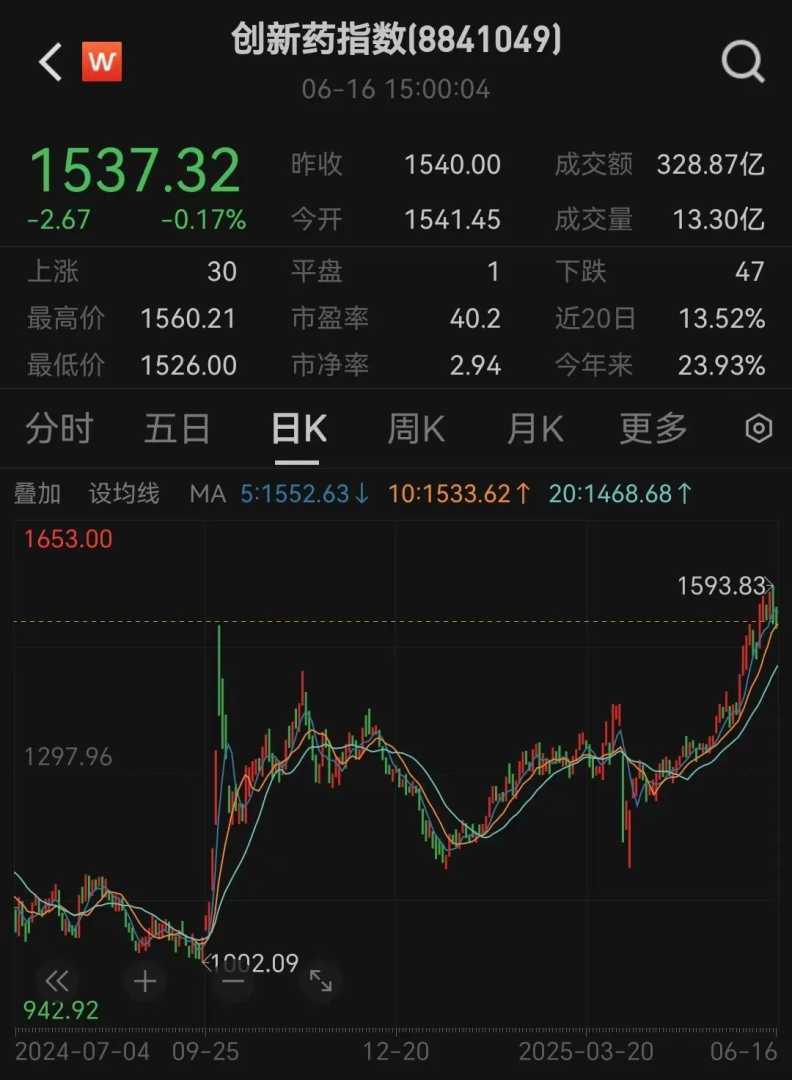
自2024年9月24日以来,Wind创新药指数已累计上涨53%。6月16日,Wind创新药指数为1537.32点,微跌0.17%。
以下为征求意见稿全文内容。
关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)
为积极响应国家加快发展新质生产力的号召,支持创新药研发,国家药品监督管理局于2024年启动了优化创新药临床试验审评审批试点工作。现根据《国务院办公厅意见》精神,总结试点经验,就进一步优化创新药临床试验审评审批事项公告如下:
一、为加速创新药研发,提高研发效率,对满足条件的创新药临床试验申请,将在30个工作日内完成审评审批。
二、30日快速通道主要支持国家重点研发品种,鼓励全球同步研发及国际多中心临床试验,以满足临床急需,推动医药产业发展。
三、纳入30日通道的申请需为1类创新药,且满足特定条件之一。
四、申请人需提交充分资料证明伦理审查、研究者能力及合规情况,具备与研发风险相适应的风险评估和管理能力,并承诺在获批后12周内启动临床试验。
五、申报资料要求由国家药品监督管理局药品审评中心制定发布。
六、若因技术原因无法在30日内完成审评审批,将及时告知申请人,后续时限按60日默示许可执行。
本公告自发布之日起生效。
特此公告。
(文章来源:中国基金报)
郑重声明:以上内容与本站立场无关。本站发布此内容的目的在于传播更多信息,本站对其观点、判断保持中立,不保证该内容(包括但不限于文字、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关内容不对各位读者构成任何投资建议,据此操作,风险自担。股市有风险,投资需谨慎。如对该内容存在异议,或发现违法及不良信息,请发送邮件至yxiu_cn@foxmail.com,我们将安排核实处理。











